Название продукта:Метилэтилкетон
Молекулярный формат:C4H8O
Номер CAS:78-93-3
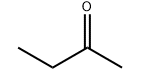
Молекулярная структура продукта:
Спецификация:
| Элемент | Единица | Ценить |
| Чистота | % | 99,8 мин. |
| Цвет | АПХА | 8макс |
| Кислотное число (в виде ацетатной кислоты) | % | 0,002макс |
| влага | % | 0,03макс |
| Появление | - | Бесцветная жидкость |
Химические свойства:
Метилэтилкетон восприимчив к различным реакциям из-за своей карбонильной группы и активного водорода, прилегающего к карбонильной группе. Конденсация происходит при нагревании с соляной кислотой или гидроксидом натрия с образованием 3,4-диметил-3-гексен-2-она или 3-метил-3-гептен-5-она. При длительном воздействии солнечного света образуются этан, уксусная кислота и продукты конденсации. При окислении азотной кислотой образуется диацетил. При окислении сильными окислителями, такими как хромовая кислота, образуется уксусная кислота. Бутанон относительно устойчив к нагреванию, и термическое расщепление при более высоких температурах дает енон или метиленон. При конденсации с алифатическими или ароматическими альдегидами образуются высокомолекулярные кетоны, циклические соединения, конденсация кетонов и смолы. Например, конденсация с формальдегидом в присутствии гидроксида натрия сначала дает 2-метил-1-бутанол-3-он, а затем дегидратирует до метакрилатона.
Смолообразование происходит под воздействием солнечного света или УФ-излучения. Конденсация с фенолом даёт 2,2-бис(4-гидроксифенил)бутан. Реагирует с алифатическими эфирами в присутствии основного катализатора с образованием β-дикетонов. Ацилирование ангидридом кислоты в присутствии кислотного катализатора приводит к образованию β-дикетонов. Реагирует с цианистым водородом с образованием циангидрина. Реагирует с аммиаком с образованием производных кетопиперидина. α-Атом водорода бутанона легко замещается галогенами с образованием различных галогенированных кетонов, таких как 3-хлор-2-бутанон при взаимодействии с хлором. Взаимодействие с 2,4-динитрофенилгидразином даёт жёлтый 2,4-динитрофенилгидразон.
Приложение:
Метилэтилкетон (2-бутанон, этилметилкетон, метилацетон) — органический растворитель с относительно низкой токсичностью, находящий широкое применение. Он используется в промышленных и коммерческих продуктах в качестве растворителя для клеев, красок и чистящих средств, а также в качестве депарафинирующего растворителя. Метилэтилкетон, являющийся естественным компонентом некоторых пищевых продуктов, может выделяться в окружающую среду при извержениях вулканов и лесных пожарах. Он используется в производстве бездымного пороха и бесцветных синтетических смол, в качестве растворителя и для покрытия поверхностей. Он также используется в качестве ароматизатора в пищевых продуктах.
МЭК используется в качестве растворителя для различных покрытий, например, винила, клеев, нитроцеллюлозы и акрила. Он используется в средствах для удаления краски, лаках, олифах, аэрозольных красках, герметиках, клеях, магнитных лентах, печатных красках, смолах, канифолях, чистящих растворах, а также для полимеризации. Он также встречается в других потребительских товарах, например, в бытовых и хозяйственных цементах, а также в древесных наполнителях. МЭК используется для депарафинизации смазочных масел, обезжиривания металлов, в производстве синтетической кожи, прозрачной бумаги и алюминиевой фольги, а также в качестве промежуточного химического продукта и катализатора. Он используется в качестве экстракционного растворителя при обработке пищевых продуктов и их ингредиентов. МЭК также может использоваться для стерилизации хирургического и стоматологического оборудования.
Помимо производства, источниками МЭК в окружающей среде являются выхлопные газы реактивных двигателей и двигателей внутреннего сгорания, а также промышленная деятельность, такая как газификация угля. МЭК в значительных количествах содержится в табачном дыме. МЭК образуется биологическим путём и идентифицирован как продукт микробного метаболизма. Он также обнаружен в растениях, феромонах насекомых и тканях животных, и МЭК, вероятно, является второстепенным продуктом нормального метаболизма млекопитающих. Он стабилен в обычных условиях, но при длительном хранении может образовывать пероксиды, которые могут быть взрывоопасны.
Категории продуктов
-

Телефон
-

Электронная почта
-

Ватсап
-

Вершина













